BÀI 8: AMONIAC VÀ MUỐI AMONI


A. AMONIAC
I. CẤU TẠO PHÂN TỬ
- Nếu bạn muốn tìm hiểu hãy click vào đây: cautaophantu
II. TÍNH CHẤT VẬT LÍ
-Nếu bạn muốn tìm hiểu hãy click vào đây: tinhchatvatli
III. TÍNH CHẤT HÓA HỌC
1. Tính bazơ yếu
a) Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
Câu hỏi 1: Khi cho quỳ tím vào dung dịch amoniac thì có hiện tượng gì xảy ra?
b) Tác dụng với dung dịch muối:
- Dung dịch amoniac có thể tác dụng với dung dịch muối của nhiều kim loại, tạo thành kết tủa hidroxit của kim loại đó.
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
c) Tác dụng với axit:
- Khí amoniac, cũng như dung dịch amoniac, tác dụng với dung dịch axit tạo ra muối amoni.
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
2. Tính khử
- Trong phân tử amoniac, nitơ có số oxi hóa -3, là số oxi hóa thấp nhất, vì vậy amoniac có tính khử. Tính chất này được thể hiện khi amoniac tác dụng với các chất oxi hóa khác.
a) Tác dụng với oxi:
- Amoniac cháy trong oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước.
4NH3 + 3O2 → 2N2 + 6H2O
b) Tác dụng với Clo:
- Clo oxi hóa mạnh amoniac tạo ra nitơ và hiđro Clorua:
2NH3 + 3Cl2 → N2 + 6HCl
- Đồng thời NH3 kết hợp với HCl tạo thành ''khói trắng'' NH4Cl
IV. ỨNG DỤNG
- Nếu bạn muốn tìm hiểu hãy click vào đây: ungdung
V. ĐIỀU CHẾ
- Nếu bạn muốn tìm hiểu hãy click vào đây: dieuche
IV. ỨNG DỤNG
- Nếu bạn muốn tìm hiểu hãy click vào đây: ungdung
V. ĐIỀU CHẾ
- Nếu bạn muốn tìm hiểu hãy click vào đây: dieuche
B. MUỐI AMONI
- Muối amoni là chất tinh thể ion, gồm cation amoni NH4+ và anion gốc axit .
I. TÍNH CHẤT VẬT LÍ
- Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion. Ion NH4+ không có màu.
II. TÍNH CHẤT HÓA HỌC
1. Tác dụng với dung dịch kiềm
- Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sẽ cho khí amoni bay ra.
NH4Cl + NaOH → NH3 + H2O + NaCl
Câu hỏi 2: Vậy người ta dựa vào tính chất gì để nhận biết dung dịch muối amoni?
2. Phản ứng nhiệt phân
- Các muối amoni dễ bị phân hủy bởi nhiệt.
* Muối amoni chứa gốc axit không có tính oxi hóa khi đun nóng bị phân hủy thành amoniac.
NH4Cl → NH3 + HCl
* Muối amoni chứa gốc axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2O, N2
NH4NO2 → N2 + 2H2O
Câu 1: Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
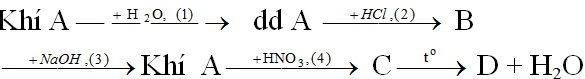
I. TÍNH CHẤT VẬT LÍ
- Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion. Ion NH4+ không có màu.
II. TÍNH CHẤT HÓA HỌC
1. Tác dụng với dung dịch kiềm
- Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sẽ cho khí amoni bay ra.
NH4Cl + NaOH → NH3 + H2O + NaCl
Câu hỏi 2: Vậy người ta dựa vào tính chất gì để nhận biết dung dịch muối amoni?
2. Phản ứng nhiệt phân
- Các muối amoni dễ bị phân hủy bởi nhiệt.
* Muối amoni chứa gốc axit không có tính oxi hóa khi đun nóng bị phân hủy thành amoniac.
NH4Cl → NH3 + HCl
* Muối amoni chứa gốc axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2O, N2
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2Ob
C. CŨNG CỐ KIẾN THỨC
1. Bài tập Câu 1: Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
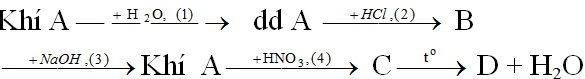
Biết rằng A là hợp chất của nitơ.
Câu 2: Trình bày phương pháp hoá học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng đã dùng.
Câu 3: Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3 số oxi hoá của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá?
Câu 4: Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
2. Giải đáp câu hỏi:
Câu hỏi 1: Khi cho quỳ tím vào dung dịch amoniac thì có hiện tượng gì xảy ra?
=> Vì khí amoniac kết hợp với ion H+ của nước, tạo thành ion amoni NH4+ và giải phóng ion hiđroxit OH−, làm cho dung dịch có tính bazơ nên làm quỳ tím hóa xanh.
Câu hỏi 2: Vậy người ta dựa vào tính chất gì để nhận biết dung dịch muối amoni?
=> Khi dung dịch amoni tác dụng với dung dịch kiềm sẽ tạo ra khí amoniac.
=> Khi dung dịch amoni tác dụng với dung dịch kiềm sẽ tạo ra khí amoniac.
3. Kiểm tra 15 phút:
Câu 1: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trồ là
chất oxi hóa ?
A. 2NH3 +
H2O2 +MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 +
3Cl2 → N2 + 6HCl
C. 4NH3 +
5O2 → 4NO + 6H2O
D. 2NH3 +
2 Na → 2NaNH2 + H2
Câu 2: Dãy các chất đều phản ứng với NH3 trong điều kiện
thích hợp là :
A. HCl, O2, Cl2, FeCl5. B.
H2SO4, Ba(OH)2, FeO, NaOH
C. HCl, HNO3,
AlCl3,
CaO D. KOH, HNO3, CuO, CuCl2
Câu 3: Nhận xét nào sau đây không đúng về muối
amoni ?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. các muối amoni đều bị thủy phân trong nước.
Câu 4: Trộn 300 ml dung dịch NaNO2 2M với 200 ml dung
dịch NH4Cl 2M rồi đun
nóng cho đến khi phản ứng xảy ra hoàn toàn. Thể tích khí thu được ở đktc là
A. 22,4 lít. B. 13,44 lít. C. 8,96
lít. D. 1,12 lít.
Câu 5: Khí nào sau đây làm xanh quỳ tím ẩm
A.Cl2
B.O2
C.SO2
D.NH3
Câu 6: Khi nhiệt phân, muối nào sau đây không thể thu được khí oxi:
A.NH4NO2
B.AgNO3
C.NaNO3
D.CU(NO3)2
Câu 7: Nitơ trong chất nào sau đây vừa có tính oxi hóa vừa có tính khử:
A. NH3
B.NO2
C.NO
D.N2
Câu 8: Cho V1(L) khí tác dụng với V2(L) khí thu được 11,2L khí (đktc).
Tính V1 và V2 biết hiệu suất của phản ứng là 50%.
A.V1= 22,4 L và V2= 22,4
L
B.V1= 22,4 L và V2= 67,2 L
C.V1= 11,2 L và V2= 33,6 L
D.V1= 22,4 L và V2= 33,6 L
Câu 9: Cho dung dịch NaOH dư vào 150,0ml
dung dịch (NH4)2SO4 1,00M. Đun nóng nhẹ , thể tích khí thu được (đktc) là
bao nhiêu ?
A.3,36 lít B.33,60 lít C. 7,62 lít D.6,72 lít
Câu 10: NH3 phản ứng với chất nào
sau đây thì thể hiện tính bazơ
A.O2
B.Cl2
C.H2
D.HCl
ĐÁP ÁN
Câu
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
Đáp án
|
D
|
A
|
A
|
C
|
D
|
A
|
D
|
B
|
D
|
D
|















amoniac có mùi khai đúng k ạ
Trả lờiXóaamoniac có tan trong nước không ạ ?
Trả lờiXóaGood
Trả lờiXóaGood
Trả lờiXóaTại sao NH3 + O2 lại ko ra NO mà lại là N2 ạ ??
Trả lờiXóa